齋藤グループ
- 小胞体ストレス応答系の活性化機構と生体制御
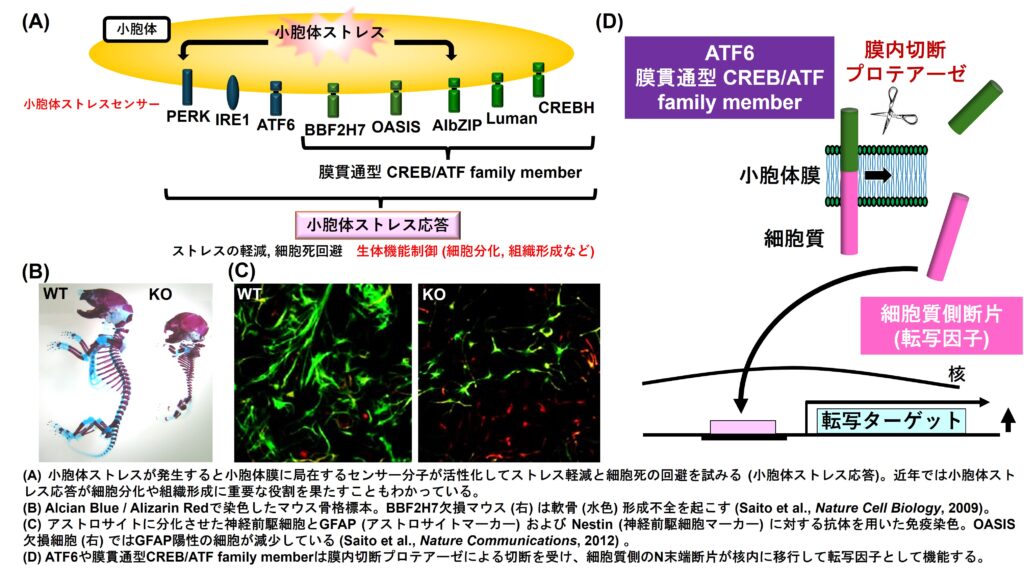
細胞が様々なストレスに曝されると、折りたたみが不完全な不良タンパク質が小胞体内腔に蓄積し、小胞体ストレスと呼ばれる状態に陥ります。この危機的状態を回避するために、小胞体膜には小胞体ストレスセンサー分子が備わっており、小胞体ストレスを軽減するためのシグナルを発信します(小胞体ストレス応答、unfolded protein response:UPR)。一方でセンサー分子から発信されるシグナルが単に小胞体ストレスを回避するためだけではなく、細胞分化や組織形成に必須であることを証明してきました。これらセンサー分子のうち、特に膜内切断という特殊な機構で活性化するATF6およびATF6と類似構造をもつ膜貫通型CREB/ATF family member(OASISファミリー分子)のストレス感知・膜内切断制御・下流シグナルによる生体制御の解明を目指しています。
関連文献
- Saito et al., Nature Cell Biology (2009).
- Saito et al., Nature Communications (2012).
- Saito et al., Molecular Cell (2014).
- Saito et al., Journal of Neurochemistry (2018).
- オルガネラ間の機能連携による脂質・エネルギー代謝制御
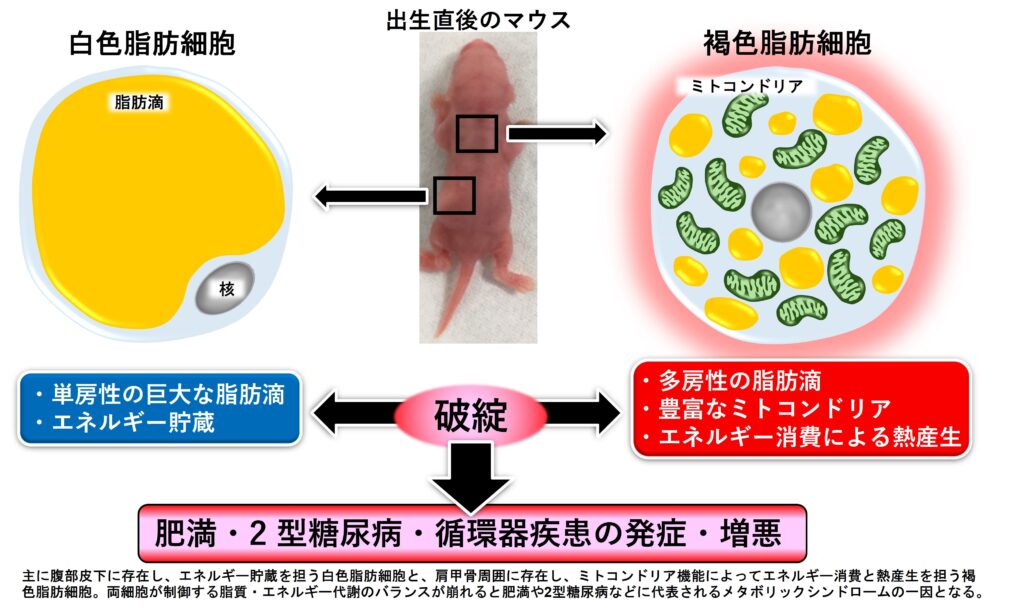
小胞体ストレスセンサーとしても機能する小胞体膜局在分子BBF2H7が、小胞体とは異なるオルガネラであるミトコンドリアの機能に関わることを発見しています。特にミトコンドリア機能を介して熱産生とエネルギー代謝といった細胞特有の機能を獲得する褐色脂肪細胞においてBBF2H7が重要な役割を果たしていることが示唆されており、その分子機構を解明するとともにメタボリックシンドロームなどを克服のための創薬につなげることを試みています。
関連文献
- Matsuhisa and Saito et al., FASEB Journal (2020).
- オルガネラ間の機能連携による細胞周期と細胞老化制御

小胞体膜は核膜と構造的に連結しており、様々な物質と情報が交換されています。最近、小胞体ストレスセンサー分子OASISが核膜の破綻部に集積し、その修復や保護に関わることを見出しました。OASISが機能不全に陥るとDNA損傷の亢進や細胞周期進行の加速を伴う細胞老化抑制などが認められます。現在、OASISが核膜の異常を感知する仕組みや膜が破綻している局所に集積するメカニズム、そして局所からのシグナル発信までの一連のシステムを紐解き、OASISを介した小胞体-核の機能連携による細胞周期や老化制御の分子機構解明を目指しています。
関連文献
- Kamikawa, Saito et al., Cell Death Discovery (2021).
- Saito et al., Cell Reports (2023).
- 創薬ターゲットとオルガネラ機能制御の化合物探索
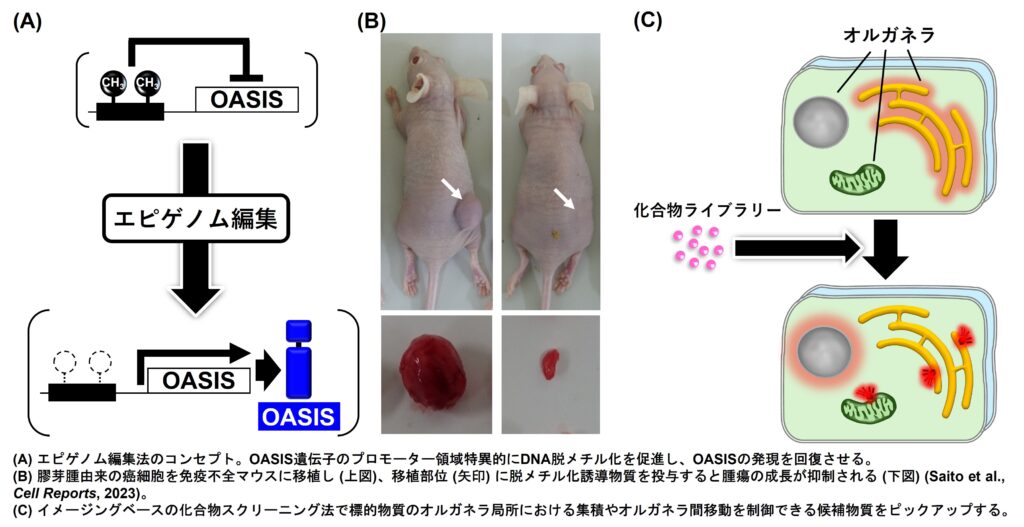
OASISの機能不全による細胞周期や細胞老化制御の異常は疾患とも深く関わります。OASIS遺伝子のプロモーター領域が高度にDNAメチル化されることで様々な癌の発症に関わることがわかってきました。エピゲノム編集技術を応用してOASIS遺伝子プロモーターのDNA脱メチル化を引き起こすと、膠芽腫細胞を由来とする腫瘍の成長を抑制することができました。この脱メチル化法や作用物質の投与方法のオプティマイズ化を図り、多くの癌に応用可能な新しい治療戦略の足掛かりとすることに挑戦しています。
標的物質のオルガネラ局所における集積やオルガネラ間移動を制御できる化合物の探索にも挑んでいます。標的物質の可視化によるイメージングベースの化合物スクリーニングでオルガネラ機能の制御が可能な候補物質を選定し、創薬へとつなげたいと思います。
関連文献
- Osaki, Saito et al., Cell Death & Diseases (2018).
- Saito et al., Cell Reports (2023).
- 神経シナプス微細構造の再構成系構築と神経疾患発症機序解析
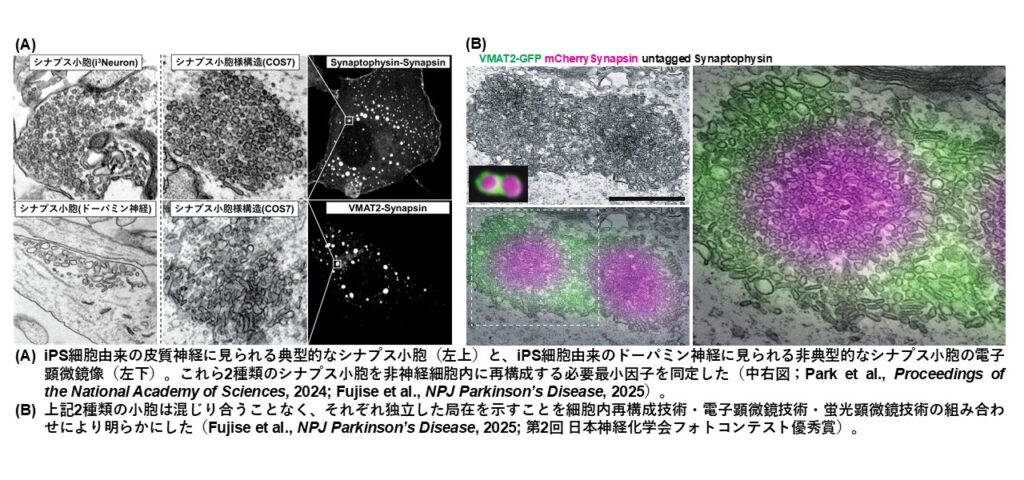
シナプス小胞は、神経の情報伝達に必要な情報伝達物質を内包する直径40nmの微細小胞です。脳組織において刺激に応じてダイナミックに制御される微細構造の形成メカニズムを捉えるために、取り扱いが容易な非神経培養細胞にシナプス小胞を人工的に形成させ、細胞内における最小形成因子を発見してきました。また、iPS細胞を使い、ドーパミン神経に非典型的なサイズのドーパミンシナプス小胞も発見するとともに、その最小形成因子や形成経路も突き止めました。シナプス小胞の形成メカニズムや神経種における分子組成の違い、他の神経微細構造の形成メカニズムやその破綻に起因する神経疾患発症機序の解明を目指しています。
関連文献
- Park, Fujise et al., Proceedings of the National Academy of Sciences (2024).
- Fujise et al., NPJ Parkinsons Disease (2025).
- Fujise et al., Trends in Neurosciences (2025).
- 骨格筋微細構造の再構成系と先天性ミオパチー発症機序解析
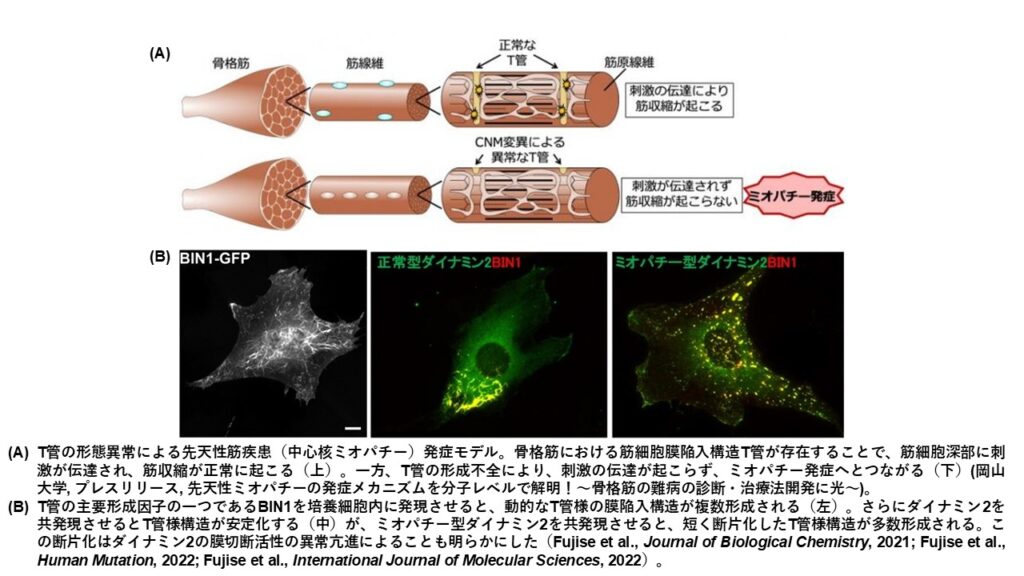
骨格筋や心筋にはT管と呼ばれる筋細胞膜陥入構造が、筋細胞深部まで網目のように張り巡らされています。神経刺激などにより伝達される電気刺激はT管上の電位依存性チャネルを開口し、続いてT管に近接する筋小胞体上のカルシウムチャネルを開口させ、筋小胞体内のカルシウムが細胞内に流入することで筋収縮が起こります。一部の先天性筋疾患では、T管の形成不全や形態異常が筋疾患発症に関与することが知られています。これまでに膜の変形や切断に関わるBIN1とDynamin2のT管形態形成や維持機構を明らかにするとともに、筋疾患変異を導入したDynamin2のT管の異常切断が生じることを再構成技術を用いて示してきました。
関連文献
- Fujise et al., Journal of Biological Chemistry (2021).
- Fujise et al., Human Mutation(2022).
- Fujise et al., International Journal of Molecular Sciences (2022).
- 電子顕微鏡を用いたナノスケール微細構造解析
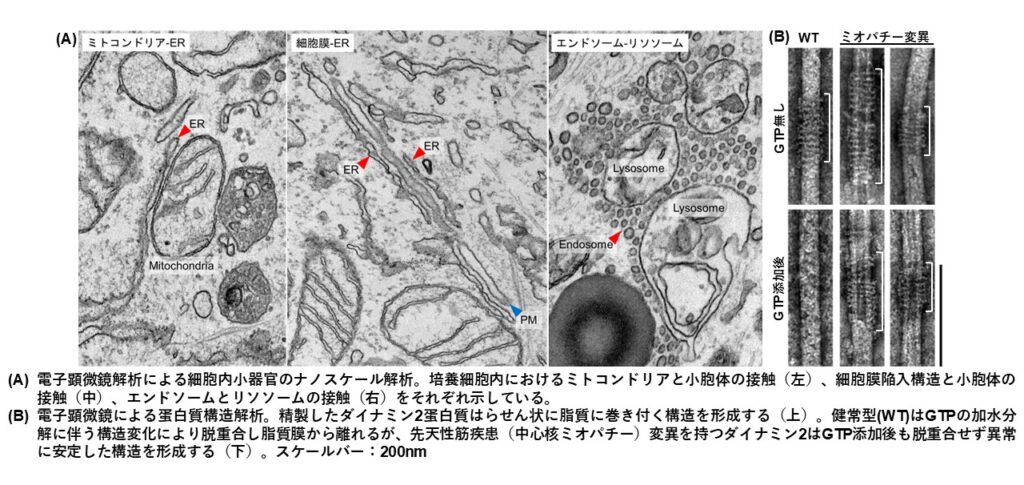
電子顕微鏡の分解能は光学顕微鏡の約1000倍にあたる約0.1nm~数nmで、原子レベルからナノスケールの解析を可能とします。この電子顕微鏡技術を駆使して、シナプス小胞をはじめ、細胞内のオルガネラコンタクトサイト、一次繊毛、蛋白質構造、マウス脳組織などの観察を行い、微細構造を詳細に解析してきました。通常の電子顕微鏡解析に加え、光学顕微鏡で観察した目的物を電子顕微鏡レベルで解析するCLEMイメージング、3次元立体構造を構築するトモグラフィー法、抗体と金粒子を用いてナノレベルで目的蛋白質の局在を示す免疫電子顕微鏡法など、様々な電子顕微鏡法を用いた解析も行っています。ナノスケールによる解析を通して、細胞内微細構造の形成機序の解明や疾患による影響などを可視化していくことに挑戦しています。
参考文献
- Fujise et al., Journal of Biological Chemistry (2021).
- Park, Fujise et al., Proceedings of the National Academy of Sciences (2024).
- Fujise et al., NPJ Parkinsons Disease (2025).
- Dai, Fujise e al., Journal of Cell Biology (2025).
- Michael, Fujise et al., EMBO Journal (2025).
